





《有机化学·第八章醇、酚、醚PPT课件(张文勤)》是由用户上传到老师板报网,本为文库资料,大小为7.14 MB,总共有124页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 124页
- 7.14 MB
- VIP模板
- ppt
- 数字产品不支持退货
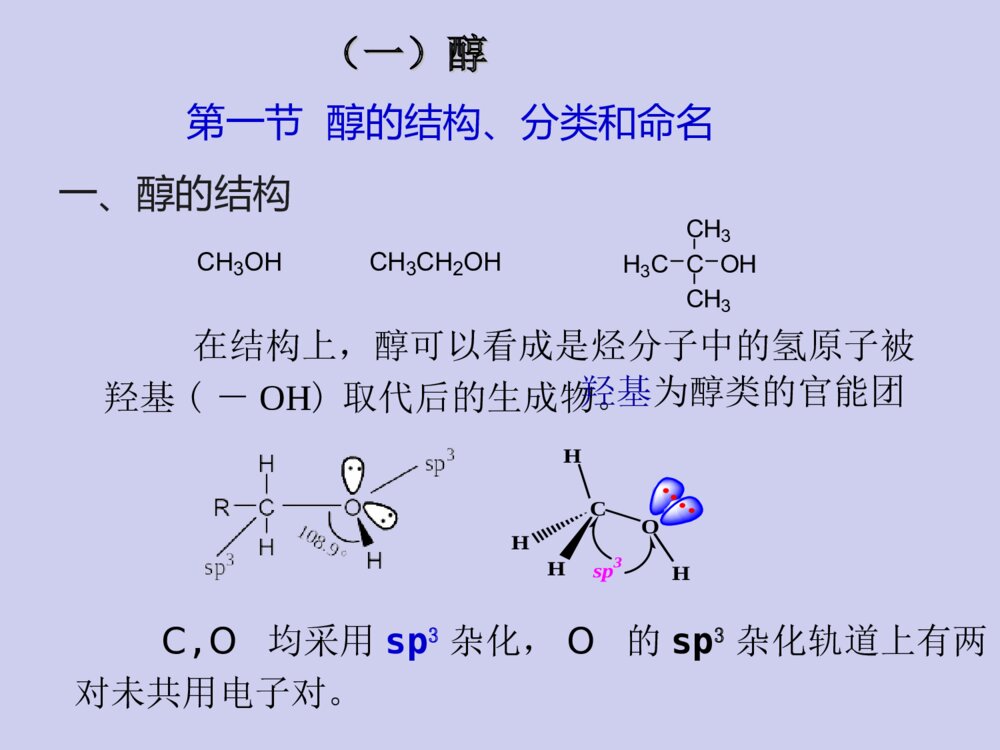
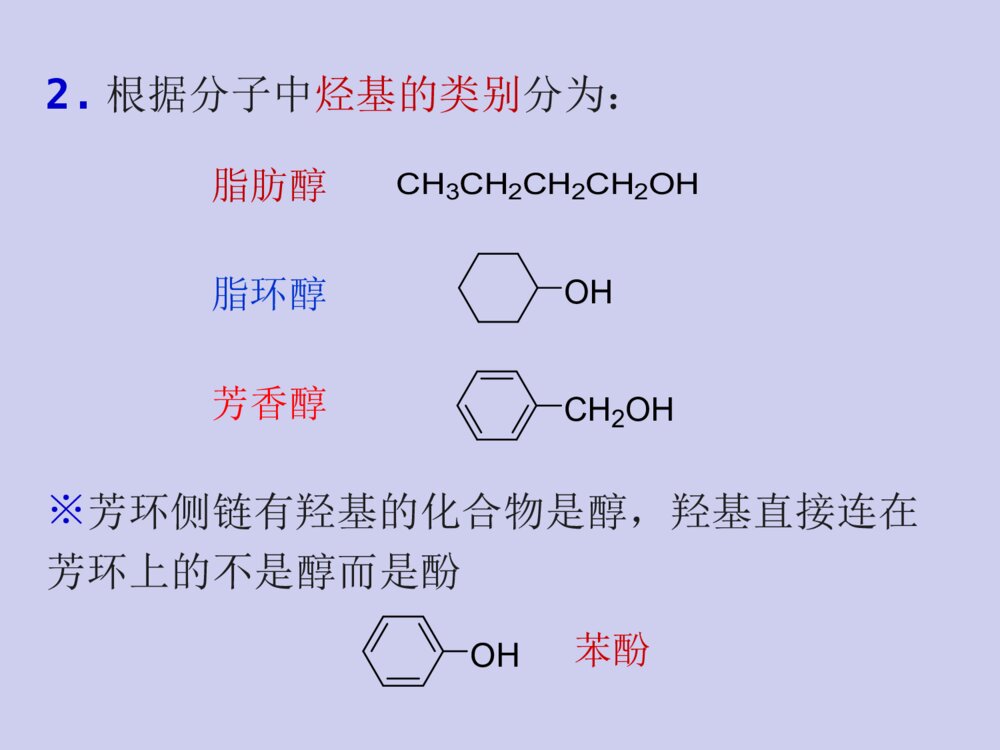
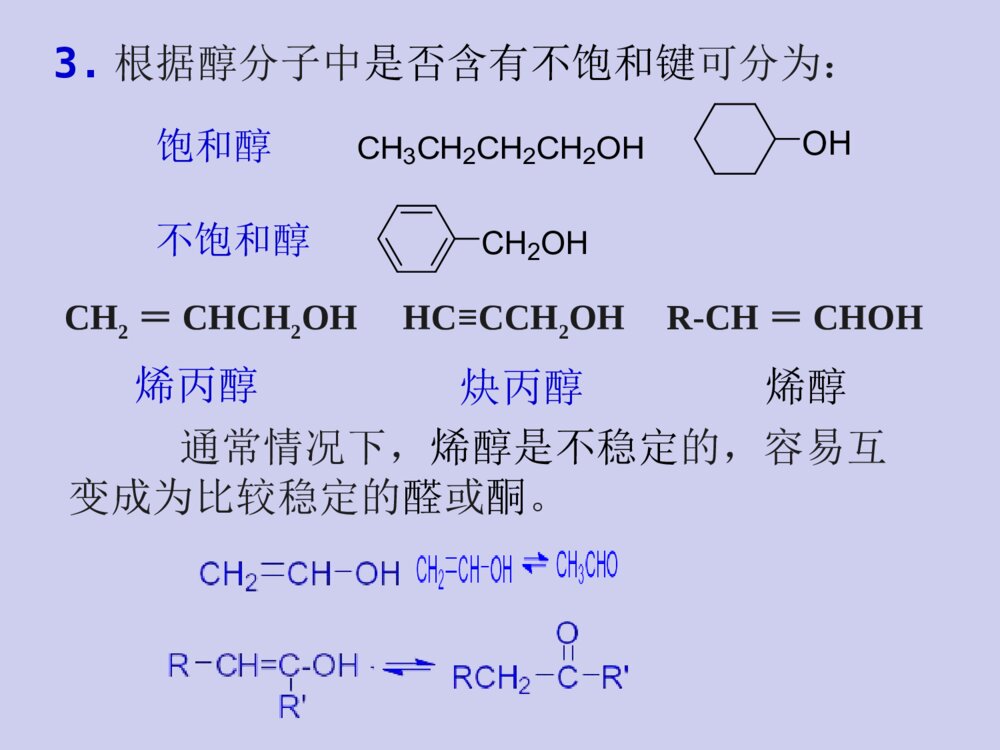
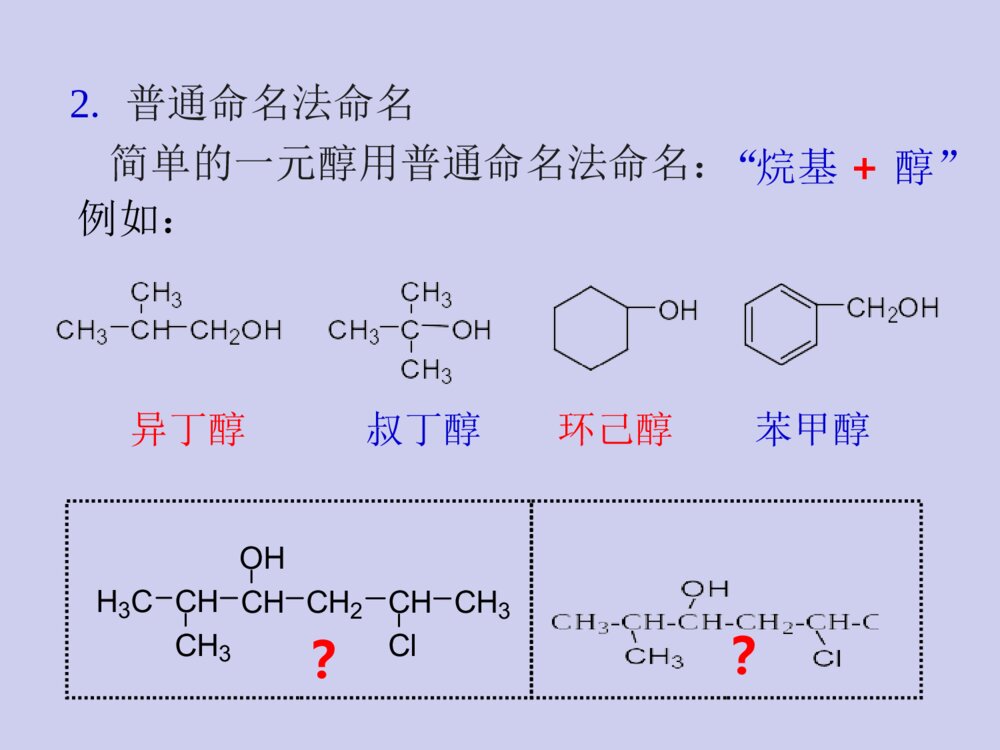
教材与参考书教材:《有机化学》张文勤编,高教出版社参考书:《有机化学》汪小兰编,高教出版社《有机化学》曾昭琼编,高教出版社《有机化学》王积涛编,南开大学出版社《有机化学学习指南》张文勤编,高教出版社《有机化学简明教程》高占先编,高教出版社学习有机化学的方法正负相吸,能量最低电子转移,箭头方向☆掌握有机化合物的结构特点和一般规律;结构决定性质,性质反映结构☆掌握有机反应机理;☆多问为什么,杜绝想当然☆根据反应机理来记忆有机反应;☆认真听课,独立完成作业。☆记住一些特殊反应;第八章醇、酚、醚第八章醇、酚、醚教学目的和要求:掌握各类官能团的结构特点,各类化合物的化学性质,并能正确运用这些知识解决各种问题。教学重点:醇、酚和醚的化学性质,碳正离子重排以及β-消除反应机理。教学难点:碳正离子重排以及β-消除反应机理。(一)醇(一)醇H3CCOHCH3CH3在结构上,醇可以看成是烃分子中的氢原子被羟基(-OH)取代后的生成物。第一节醇的结构、分类和命名一、醇的结构羟基为醇类的官能团C,O均采用sp3杂化,O的sp3杂化轨道上有两对未共用电子对。COHHHHsp3CH3OHCH3CH2OH1.根据羟基所连碳原子种类可分为:二、醇的分类一级醇(伯醇)二级醇(仲醇)三级醇(叔醇)CH3CH2CH2CH2OHCH3CH2CHOHCH3H3CCOHCH3CH32.根据分子中烃基的类别分为:CH2OHOHCH3CH2CH2CH2OH脂肪醇脂环醇芳香醇※芳环侧链有羟基的化合物是醇,羟基直接连在芳环上的不是醇而是酚OH苯酚3.根据醇分子中是否含有不饱和键可分为:CH2=CHCH2OH烯丙醇HC≡CCH2OH炔丙醇R-CH=CHOH烯醇通常情况下,烯醇是不稳定的,容易互变成为比较稳定的醛或酮。饱和醇不饱和醇CH3CH2CH2CH2OHOHCH2OH4.根据分子中所含羟基的数目分为:HOCH2CH2OHHOCH2CHCH2OHOHCH3CH2OH一元醇二元醇多元醇三、醇的命名1.俗名乙醇俗称丙三醇俗称酒精甘油2.普通命名法命名例如:H3CCHCH3CHOHCH2CHClCH3??简单的一元醇用普通命名法命名:“烷基+醇”异丁醇叔丁醇环己醇苯甲醇选择含有羟基的最长碳链为主链,使羟基的位置编号最小,……称为某醇。3.系统命名法结构比较复杂的醇,采用系统命名法。H3CCHCH3CHOHCH2CHClCH32-甲基-5-氯-3-己醇4-戊烯-2-醇命名规则:选主链定位次写全名H3COHCH2OHCCH3OHCH3CH2OHH3CCHCH3OHCH3OH4-甲基环己醇环己甲醇2-苯基-2-丙醇1-苯基乙醇1-甲基环己醇4-甲基苯甲醇8-壬烯-6-炔-4-醇CH3OHHO2-甲基-1,3-环戊二醇多元醇的命名:CH3-CH-CH-CH2-CH-CH3OHOHBr5-溴-2,3-己二醇选择含-OH尽可能多的碳链为主链,含有几个羟基称为几醇CH2-CH2-CH2OHOH1,3-丙二醇丙三醇CH2-CH-CH2OHOHOH※两个羟基连在同一碳上的化合物不稳定,这种结构会自发失水,故可认为同碳二醇不存在。2.碳原子数相同的醇则含支链愈多的沸点愈低第二节醇的物理性质一、沸点:1.直链饱和一元醇的沸点随着碳原子数的增加而有规律的上升。丁醇2-甲基-1-丙醇2-甲基-2-丙醇CH3CHCH2OHCH3CH3COHCH3CH3CH3CH2CH2CH2OH沸点:117℃108℃82℃C1-C12为液体,C13及以上为固体3.比相同C原子数的烃、卤代烃、醚、醛、酮高乙烷乙醇bp:-88.6℃bp:78.3℃形成氢键而缔合?原因:直链饱和一元醇的沸点随相对分子质量的增加与相应的烷烃愈来愈接近4.分子中羟基越多,沸点越高。二、溶解度:甲、乙、丙醇与水以任意比混溶C4以上则随着碳链的增长溶解度减小分子中羟基增加,亲水作用增强,在水中的溶解度增大。亲油基团亲水基团ROH烃基增大,憎水作用增强,在水中的溶解度减小。苯甲醇能否与水任意比混溶?不能原因?(憎水基团)三、结晶醇的形成低级醇能和一些无机盐(MgCl2、CaCl2、CuSO4等)作用形成结晶醇,亦称醇化物。如:结晶醇结晶醇不溶于有机溶剂而溶于水※MgCl2、CaCl2、CuSO4不能用来干燥低级醇除去少量低级醇应用:第三节醇的化学性质醇的化学性质主要由羟基官能团所决定,同时烃基也受到一定的影响。分子中的C—O键和O—H键都是极性键,因而醇分子中有两个反应中心。CCHOHHRHR\'又由于受C—O键极性的影响,使得α-H和β-H具有一定的活性,所以醇的反应主要发生在这四个部位上。结构决定性质一、与活泼金属的反应故常利用醇与Na的反应销毁残余的金属钠,而不发生燃烧和爆炸。Na与醇的反应比与水的反应缓慢的多,并且反应所生成的热量不足以使氢气自燃。——似水性金属镁、铝也可与醇作用生成醇镁、醇铝。2C2H5OH+MgI2(C2H5O)2Mg+H2↑乙醇镁——酸性CH3CHOHCH36+2Al2CH3CHOCH3()3Al+3H2还原剂有机合成中常用的试剂醇与金属反应的活性CH3OHCH3CH2OHCH3CHOHCH3CH3CCH3CH3OH>>>甲醇>伯醇>仲醇>叔醇溶液中:二、与卤代物反应1.与氢卤酸反应+HXRXROH+H2O卤代烃醇与氢卤酸反应的特点:(卤代烃的生成)1)反应机理SN仲醇、叔醇、烯丙醇、苄醇通常采取SN1伯醇通常采取SN2aSN2机理??????盐碱性aSN2机理构型翻转bSN1机理??????盐构型保持+构型翻转完成反应:机理:有碳正离子中间体时一定要考虑重排CH3CCH3CH3CHHOHCH3CCH3CH3CHHOH2CH3CCH3BrCHHCH3H+重排(H迁移)主要产物-H2OCH2CCH2CHHCH3(3o碳正离子)CH3CCH3CH3CHH(2o碳正离子)Br-完成反应:机理:※β位上位阻大的伯醇与HX的反应常有重排产物生成2)总的反应活性烯丙式醇叔醇仲醇伯醇CH3OHHIHBrHCl与它们酸性大小一致>>>>>>适用于C6以下叔、仲、伯醇的鉴别醇的鉴别氯化锌和浓盐酸所配成的溶液称为卢卡斯(Lucas)试剂醇反应活性的应用:2.醇与卤化磷和亚硫酰氯反应亚硫酰氯氯化亚砜产物纯净(1)ROH+PCl5R-Cl+POCl3+HCl(2)ROH+SOCl2R-Cl+SO2+HCl(3)不重排反应特点:无吡啶等弱碱存在产物构型保持有吡啶等弱碱存在产物构型翻转解释:COHRR\'HSOClClCO+RR\'HSO-ClCl+-+H-HClCORR\'HSOCl有吡啶时构型翻转吡啶COHRR\'HSOClClCO+RR\'HSO-ClCl+-+H-HClCORR\'HSOClCClRR\'H无吡啶时构型保持3.成酯反应(与酸反应)1)与有机酸反应可逆反应a.生成羧酸酯酸脱羟基醇脱氢规律:b.生成磺酸酯TsO-是弱碱,很好的离去基团,易发生亲核取代和消除反应。TsClSClOOCH3SOOOCH3吡啶72%R+OHR对甲苯磺酰氯H3CSO2Ts=醇与磺酰氯反应则生成磺酸酯对甲苯磺酸烷基酯对甲苯磺酸烷基酯的取代反应一般为SN2机理,消除反应一般为E2机理在涉及立体化学的某些反应中有着独特的优点例子:由制备CHOHCH3CH2CH2CH3CHOTsCH3CH2CH2CH3CHICH2CH2CH3CH3TsClNaI吡啶丙酮构型不变(R)-2-戊醇(S)-2-碘戊烷构型翻转SN1SN2例子:由制备SN1主SN2构型保持剧毒CH3OSO2OH+HOSO2OCH3减压蒸馏CH3OSO2OCH3+H2SO4醇与含氧无机酸反应生成无机酸酯2)与无机酸反应H2SO4、HNO3、H3PO4等与浓硫酸作用生成硫酸酯化工和轻纺工业作乳化剂、浮选剂和浸透剂应用ROH+HONO2→RONO2+H2O与浓硝酸或发烟硝酸作用生成硝酸脂。三硝酸甘油酯(硝化甘油)H2SO4n-C12H25OH+44-55℃n-C12H25OSO3HNaOHorNa2CO3n-C12H25OSO3Na十二烷基磺酸钠CH2CHCH2OHOHOH+HONO2浓H2SO4CH2CHCH2ONO2ONO2ONO2+3H2O十二烷基磺酸4、脱水反应醇与催化剂共热即发生脱水反应催化剂:分子内脱水(E)分子间脱水(SN)(一)分子内脱水两种方式:CH3CH2OH浓H2SO4170℃CH2=CH2+H2OH2SO4、H3PO4醇脱水反应的特点:+H2ORCHCH2HOHH+CH=CH2R机理2)E1碳正离子中间体4)反应活性叔醇的脱水常用,也用仲醇,伯醇少用。3)1,2消除苄醇、烯丙醇>叔醇>仲醇>伯醇1)酸催化(β消除)要有β氢(相邻氢)5)主要生成札依采夫产物?6)消除反应主要产物为反式产物。(主)醇消除在满足反式消除的前提下生成稳定的产物7)用酸催化脱水时,常常有重排产物生成。主要产物频哪醇重排:机理:(二)分子间脱水主要副反应:主要副反应:成醚一般不用叔醇,为什么?制备简单醚,以伯醇最好,仲醇次之分子内脱水成烯烃。分子内脱水成烯烃。叔醇得到的往往是烯烃2ROHH+ROR+H2O醚+H2OCH3CH2OH浓H2SO4140℃CH3CH2OCH2CH35、氧化反应RCHOHH1)伯醇被氧化为羧酸伯醇、仲醇分子中的α-H原子,由于受羟基的影响易被氧化。RCOOH氧化剂:KMnO4/H+、K2Cr2O4/H+、CrO3/H2SO4、去氢加氧使用温和试剂2)伯醇被氧化为醛催化氧化利用热量:CH3CH2OHCu250~350oC+H2CH3CHOCH3CHCH3OHCu500oC,0.3MPaCH3CCH3O+H2CH3CH2OH+O2Cu或Ag550oC12+H2OCH3CHOCH3CH2OH+CuO550oC+H2OCH3CHO+Cu莎瑞特试剂(CrO3+吡啶)氧化分子中C=C、C=O、C=N等不饱和键不不被氧化,被氧化,伯醇氧化停留在醛。。莎瑞特试剂RCH2OHRCHOOHPCCCHOCrO3+HCl+NNH+CrO3Cl-PCC吡啶活性MnO2氧化H2CCHCH2OH活性MnO2H2CCHCHO只氧化烯丙式醇3)仲醇被氧化为酮CHOHR\'ROCR\'ROOHKMnO4/H+O氧化剂:KMnO4/H+、K2Cr2O4/H+、CrO3/H2SO44)叔醇不被氧化H3CCOHCH3CH3[O]6.多元醇的反应1)邻二醇与高碘酸(HIO4)反应RCR\'CHHOHOH+HIO4R\'CORHCOH++HIO3+H2O具有羟基的两个碳原子的C-C键断裂同时羟基变C=O非邻二醇无此反应CH2CH2CH2OHOHHIO42)丙三醇衍生物与高碘酸(HIO4)反应中间的羟基相当于被氧化两次CH2OHCHOHCH2OH++2IO4-甲醛甲酸甲醛HCHOHCHOHCOHO3)邻二醇衍生物与四醋酸铅(Pb(OAc)4)反应CH3CHO+HCHO+Pb(OAc)2Pb(OAc)4HOAc,50oCCH3CHCH2OHOH(了解)一、醇的工业合成方法1.由合成气合成+COH2CuO–ZnO–Cr2O3210~400°C,5~10MPaCH3OH2.由烯烃水化HCCH2R+H2OH+HCCH2HOHR(了解)第四节醇的制备Na2CO3,H2O100~150oCH2COCHCH2ClH2CCHCH2OHOHOHCa(OH)2或NaOH80~90oCH2CCHClOH+CH2ClH2CCHOHClCH2ClH2CCHOCH2Cl3.甘油的制备H2CCHCH3Cl2,500oCH2CCHCH2Cl-HClH2CCHCH2ClH2O,Cl225~30oCH2CCHClOH+CH2ClH2CCHOHClCH2Cl二、硼氢化-氧化反应三、由卤代烃水解四、由酯水解CH3COOCH2CH3NaOHCH3CH2OH+CH3COOH五、由酸还原COOHLiAlH4CH2OH六、由醛、酮制备醛、酮分子中的羰基用还原剂(NaBH4,LiAlH4)还原或催化加氢可还原为醇。不饱和醛、酮还原时,C=C不影响。1.醛、酮的还原例如:CH3CH=CHCHONaBH4H2OCH3CH=CHCH2OHRMgX与甲醛反应得伯醇,与其它醛反应得仲醇,与酮反应得叔醇。2.醛、酮与格氏试剂反应用格氏试剂与醛酮作用,可制得伯、仲、叔醇。(二)酚酚(phenol)是羟基直接与芳环相连的化合物OHOHH3CCH2OH第一节酚的结构及命名一、结构苯甲醇二、命名酚的命名一般是羟基所在C为1号位,在酚字的前面加上芳环的名称作为母体,再加上其它取代基的名称和位次。羟基与芳环侧链的化合物为芳醇OHNO2OHH3C分子中含有多种官能团时要按次序规则把羟基看作取代基来命名。2-硝基苯酚4-甲基苯酚COOHHO4-羟基苯甲酸羧酸>酯>酰卤>酰胺>腈>醛>酮>醇>胺(对羟基苯甲酸)次序规则:命名含有多个不同官能团化合物时要选择优先的官能团作为母体.官能团作为母体的优先次序为:第二节酚的物理性质酚易溶于醚等有机溶剂,有腐蚀性、毒性、杀菌性。酚毒性很大。大多数酚为无色晶体,但由于酚类化合物性质活泼,能被空气中的氧氧化而呈现粉红色或红色。苯酚微溶于冷水中,在80℃以上时可与水以任意比混溶,酚的水溶性随羟基数目的增加而增大。>OHOHOH水溶性:第三节酚的化学性质苯环上更易发生亲电取代反应,酚与醇和苯有一定共性一、酚羟基的反应1.酸性酚羟基不易被取代OHOH+NaOHONa+H2O酚的酸性比醇强,但比碳酸弱。酚能溶于氢氧化钠溶液生成钠盐,而醇不能。向生成的酚钠水溶液中通入CO2,则苯酚会重新析出来,用此性质可分离或鉴别醇和酚。酚羟基的酸性远远大于醇酸性大小:1423当苯环上连有吸电子基团时,酚的酸性增强;连有供电子基团时,酚的酸性减弱。取代酚的酸性2.酚醚的生成酚不能分子间脱水成醚,一般是由酚在碱性溶液中与烃基化试剂作用生成。OHONaOCH2ROCH3OCH2CH=CH2NaOHRCH2Br(CH3)2SO4+NaBr+NaBr+NaBr苯甲醚茴香醚苯基烯丙基醚()CH2=CHCH2Br+H2OCH3CH2OH浓H2SO4140℃CH3CH2OCH2CH3+H2O浓H2SO4140℃OHO3.酚酯的生成酚也可以生成酯,水杨酸乙酰水杨酸但比醇困难。很难反应,通常不用乙酸酐OHROH+CH3COOH解释:酚羟基亲核性低HO25oCAlCl3(主)OCCH3OOOH165oCAlCl3(主)OOCCH3O酚酯的反应酚酯的反应--------FriesFries重排重排OH+COClNaOHOCO苯甲酰氯4.与FeCl3的显色反应故此FeCl3溶液可用来鉴定酚6ArOH+FeCl3[Fe(OAr)6]3-+6H++3Cl-蓝紫色棕红色※与FeCl3的显色反应并不限于酚,烯醇式结构含量较高的化合物也有此反应。大多数酚能与FeCl3溶液发生显色反应,不同的酚与FeCl3作用产生的颜色不同,但都有明显的颜色加深。二、芳环上的亲电取代反应苯酚与溴水在常温下可立即反应生成2,4,6-三溴苯酚白色沉淀。OH+Br2(H2O)3HBrOHBrBrBr+反应很灵敏,很稀的苯酚溶液(10ppm)就能与溴水生成沉淀。1.卤代反应故常用溴水鉴别苯酚白色沉淀低温下,在CS2、CCl4等非极性溶剂中,控制溴的用量,可制得一溴代苯酚2.硝化反应苯酚比苯易硝化,在室温下即可与稀硝酸反应。如何分离两个产物?OH+Br2CS25oCOHBr分子内氢键分子间氢键分子间作用力小分子间作用力大沸点低沸点高水蒸气蒸馏可把两化合物分开3.磺化反应:100℃90%浓硫酸与苯酚的反应较易发生,反应如在室温条件下发生,则生成几乎等量的邻位和对位磺化产物。+反应如在较高温度下进行,产物以对位磺化为主。2049%51%℃可逆反应酰基化反应4.傅瑞德-克拉夫茨反应:烷基化反应酚的烷基化反应多以烯烃或醇为烷基化试剂,以浓硫酸或浓磷酸为催化剂,反应易生成多烷基化产物OH+CH3COClBF3OHCH3CO4-甲基-2,6-二叔丁基苯酚一、多元醇的反应邻羟基化合物的氧化复习回顾具有羟基的两个碳原子的C-C键断裂同时羟基变C=O(HIO4)非邻二醇无此反应CH2CH2CH2OHOHHIO4中间的羟基相当于被氧化两次(3)甘油的制备1.醇的工业合成方法二、醇的制备(2)由烯烃水化2.硼氢化-氧化反应3.由卤代烃水解4.由酯水解5.由酸还原6.由醛、酮制备1)醛、酮的还原NaBH4,LiAlH42)醛、酮与格氏试剂反应RMgX与甲醛反应得伯醇,与其它醛反应得仲醇,与酮反应得叔醇。(二)酚一、酚的结构及命名羧酸>酯>酰卤>酰胺>腈>醛>酮>醇>胺官能团作为母体的优先次序为:三、酚的化学性质1.酚羟基的反应(1)酸性取代酚的酸性(2)酚醚的生成一般是由酚在碱性溶液中与烃基化试剂作用生成(3)酚酯的生成酚也可以生成酯,但比醇困难。(4)与FeCl3的显色反应鉴别苯酚2.芳环上的亲电取代反应(1)卤代反应常用溴水鉴别苯酚(2)硝化反应(3)磺化反应:可逆反应酰基化反应(4)傅瑞德-克拉夫茨反应:烷基化反应水杨醛(邻羟基苯甲醛)5.Reimer-Tiemann反应6.与甲醛缩合酚醛树脂(了解)酚醛树脂CCH3CH3HOOHOH2+CH3COCH3+H2O30%盐酸40~60oC,>95%双酚A是制造环氧树脂、聚碳酸酯、阻燃剂等的重要原料。双酚A7.与丙酮缩合(了解)三、氧化反应酚易被氧化为醌等氧化物,氧化物的颜色随着氧化程度的深化而逐渐加深,由无色而呈粉红色、红色以致深褐色。例如:OHH2SO4OOO对苯醌(棕黄色)KMnO4+多元酚更易被氧化。OHOH2AgBrOO+2Ag+HBr酚易被氧化的性质常用来作为抗氧剂和除氧剂。(了解)此方法优点是原料价廉易得,污染小,可连续化生产,产品纯度高,且副产物丙酮也是重要的化工原料。第四节酚的制法一、异丙苯法CH(CH3)2CH3CHCH2H3PO4,250oC2.41MPa+CH(CH3)20.5~1MPaO290~130oCCCH3CH3OOHCCH3CH3OOHOHH3CCOCH3稀H2SO450~90oC+(了解)二、碱熔法CH3SO3H2SO4CH3SO3HNaOH,300°CH3O+CH3OH1.结构(三)醚一、醚的结构、分类和命名醚的通式是R-O-R、Ar-O-R或Ar-O-ArCH3OCH3如CH3-O-C2H5OCH3O2.分类OOOOOO饱和醚芳香醚不饱和醚环醚大环多醚冠醚OOOOO1)简单醚在“醚”字前面写出两个烃基的名称。例如3.命名2)混醚是将小基排前大基排后;芳基在前烃基在后,称为某基某基醚。二苯(基)醚(二)乙(基)醚甲基乙基醚苯乙醚乙二醇二乙醚乙二醇二乙醚3)结构复杂的醚较大的烃基作为母体,烃氧基作为取代基。CH3CHCH2CH2CH3OCH3CH3OCH2CH2OCH2CH2OCH32–甲氧基戊烷β,β’–二甲氧基乙醚二、醚的物理性质由于醚分子间不能形成氢键缔合,因此醚的沸点显著低于其同分异构体-醇;不易溶于水。R-O-R三、醚的化学性质醚是一类不活泼的化合物(环醚除外)醚在常温下和金属Na不起反应,可以用金属Na来干燥。1钅羊盐的生成(醚键氧的碱性)(醚键氧的碱性)利用此性质可以将醚从烷烃或卤代烃中分离出来。2.醚链的断裂(1)在较高温度下,强酸能使醚链断裂。CH3CH2OCH2CH3+HICH3CH2OCH2CH3+HI+CH3CH2OHCH3CH2I-HI(过量)2CH3CH2I+H2O羊盐是一种弱碱强酸形成的盐,仅在浓酸中才稳定,在水中分解,醚即重新分出。钅(2)不同卤化氢的反应活性大小依次为:(3)混合醚反应时,碳氧键断裂的方式:HI>HBr>HCl所以通常是用HI进行此反应。ROR\'当R为甲基或伯烷基时,反应通常以SN2的方式进行当R为叔烷基时,反应通常以SN1的方式进行当R为仲烷基时,反应方式进行根据情况而定SN2a.烷基醚b.芳基烷基醚参与断键的烃变为卤代烃,不参与断键的变为醇或酚芳香混醚断键时总是断裂烷氧键,生成酚和碘代烷SN1b.芳基烷基醚不对称醚醚键的开裂取向:3o>甲基>1o>2oSN13.Claisen重排苯基烯丙基醚及其类似物在加热的条件下,发生分子内重排生成邻烯丙基苯酚(或对位取代苯酚)的反应,称为Claisen重排。OOHOH+190~200oC主要产物OROHROH3CCH3OHH3CCH3RR4.过氧化物的生成(了解)醚长期与空气接触下,会慢慢生成不易挥发的过氧化物。CH3CH2OC2H5CH3CH-O-C2H5HOOO2+CH3CH-OHOOHnnH2OCHOOCH3-()nn=1-8过氧化物不稳定,加热时易分解而发生爆炸,因此,醚类应尽量避免暴露在空气中,一般应放在棕色玻璃瓶中,避光保存。四、醚的制备1.醇脱水R-O-H+H-O-RH2SO4R-O-R+H2O威廉姆逊合成法是制备混合醚的一种好方法。是由卤代烃与醇钠或酚钠作用而得。此法只适用于制简单醚,且限于伯醇,仲醇产量低,叔醇在酸性条件下主要生成烯烃。2.威廉姆逊合成法(A.W.Williamson)威廉姆逊合成法中只能选用伯卤代烷与醇钠为原料。例如:制备乙基叔丁基醚因为醇钠即是亲核试剂,又是强碱,仲、叔卤代烷(特别是叔卤代烷)在强碱条件下主要发生消除反应而生成烯烃CH2CH2+12O2Ag280~300oC,1~2MPaCH2CH2OCH2CHCH310%H2O2,钛硅分子筛TS-154oC,0.99MPa,98%+H2OOCH33.工业制法(了解)碳链两端或碳链中间两个碳原子与氧原子形成环状结构的醚,称为环醚:环氧乙烷1,2-环氧丙烷环氧氯丙烷1,4-二氧六环五、环醚3–氯–1,2–环氧丙烷六、重要的醚环氧乙烷化学性质活泼,在酸或碱性条件下能与多种试剂反应,形成一系列重要工业原料。1.乙醚2.环氧乙烷环氧乙烷是最简单的环醚,很重要的有机合成中间体。(1)物理性质沸点11℃,无色有毒气体,易液化,与水混溶,溶于乙醇、乙醚等有机溶剂。(2)化学性质O酸性条件下环氧乙烷可与水、醇、卤化氢等含活泼氢的化合物反应,生成双官能团化合物。酸性条件下??????盐环氧乙烷的开环反应是制备增加两个碳原子的伯醇的重要方法。碱性条件下环氧乙烷可与RO-,NH3,RMgX等反应生成相应的开环化合物。(1)RMgXO(2)H2O/H+H2CCH2OHROCH3CH2ONa+H2CCH2OHOCH2CH3酸催化碱催化不对称环氧乙烷开环碱性条件:亲核基团连在取代基多的碳上,产物羟基在取代基少的碳上酸性条件:亲核基团连在取代基少的碳上,产物羟基在取代基多的碳上?酸催化碱催化酸性条件下机理:SN1,碳正离子稳定性酸性条件产物解释:SN1SN2,位阻起决定作用碱性条件产物解释:碱性条件下机理:SN2应用:(CH3)2NH+H2NCH2CH2NH2+H2CCHOCH2ClNCH3CHOHCH2mCH2NCH2CH2CH2CHOHCH2nClClCH3CH3CHCH2CH2OHCHCH2OH高分子有机阳离子絮凝剂冠醚的结构特征是分子中具有三个以上—OCH2CH2的重复单元,由于它们的形状似皇冠,故统称冠醚(crownethers)。3.冠醚15-冠-518-冠-6这类化合物具有特有的简化命名法,名称χ-冠-y,其中的前χ代表环上原子的总数,y代表氧原子的总数。OOOOOO无机试剂KX易与18-冠-6形成配合物X=OH-,Cl-,MnO4-等。用途:冠醚与正离子络合,使该正离子可溶在有机溶剂中,而与它相对应的负离子也随同进入有机溶剂内,能与正离子,尤其是与碱金属离子络合冠醚特点:作冠醚不与负离子络合,使游离或裸露的负离子反应活性很高,能迅速反应。相转移催化剂复习回顾一、醇的结构(一)醇(一)醇第一节醇的结构、分类和命名二、醇的分类伯醇仲醇叔醇烯醇烯醇不稳定三、醇的命名结构比较复杂的醇,采用系统命名法。命名规则:选主链定位次写全名4-戊烯-2-醇多元醇的命名两个羟基连在同一碳上的化合物不稳定,可认为同碳二醇不存在第二节醇的物理性质一、沸点:2.支链愈多的沸点愈低1.随着碳原子数的增加而上升。3.比相同C原子数的烃、卤代烃、醚、醛、酮高三、结晶醇的形成第三节醇的化学性质CCHOHHRHR\'结构决定性质极性键易断裂一、与活泼金属的反应醇与金属反应的活性CH3OHCH3CH2OHCH3CHOHCH3CH3CCH3CH3OH>>>甲醇>伯醇>仲醇>叔醇溶液中:二、与卤代物反应1.与氢卤酸反应+HXRXROH+H2O卤代烃反应的特点:1)反应机理仲醇、叔醇、烯丙醇、苄醇通常采取SN1伯醇通常采取SN2有碳正离子中间体时一定要考虑重排熟悉机理先蛘盐再脱水2)总的反应活性烯丙式醇叔醇仲醇伯醇CH3OHHIHBrHCl>>>>>>醇的鉴别醇反应活性的应用:适用于C6以下叔、仲、伯醇的鉴别氯化锌和浓盐酸所配成的溶液称为卢卡斯(Lucas)试剂2.醇与卤化磷和亚硫酰氯反应与亚硫酰氯反应特点:无吡啶等弱碱存在产物构型保持有吡啶等弱碱存在产物构型翻转3.成酯反应(与酸反应)1)与有机酸反应a.生成羧酸酯可逆反应酸脱羟基醇脱氢b.生成磺酸酯对甲苯磺酸烷基酯的取代反应一般为SN2机理,消除反应一般为E2机理SClOOCH3SOOOCH3吡啶72%R+OHR例子:由制备例子:由制备2)与无机酸反应三硝酸甘油酯(硝化甘油)CH2CHCH2OHOHOH+HONO2浓H2SO4CH2CHCH2ONO2ONO2ONO2+3H2O4、脱水反应醇与催化剂共热即发生脱水反应催化剂:分子内脱水(E)成醚分子间脱水(SN)成烯两种方式:H2SO4、H3PO4(一)分子内脱水醇脱水反应的特点:+H2ORCHCH2HOHH+CH=CH2R机理2)E1碳正离子中间体1)酸催化先蛘盐再脱水4)反应活性叔醇的脱水常用,也用仲醇,伯醇少用。3)1,2消除苄醇、烯丙醇>叔醇>仲醇>伯醇(β消除)要有β氢(相邻氢)5)主要生成稳定产物反式扎伊采夫产物6)用酸催化脱水时,可能有重排产物生成频哪醇重排:(二)分子间脱水一般不用叔醇,以伯醇最好,仲醇次之成醚5.氧化反应1)伯醇被氧化为羧酸RCOOH去氢加氧强氧化剂:KMnO4/H+、K2Cr2O4/H+、CrO3/H2SO4、使用温和试剂2)伯醇被氧化为醛催化氧化莎瑞特试剂(CrO3+吡啶)氧化活性MnO2氧化只氧化烯丙式醇3)仲醇被氧化为酮4)叔醇不被氧化6.多元醇的反应1)邻二醇与高碘酸(HIO4)反应具有羟基的两个碳原子的C-C键断裂同时羟基变C=O非邻二醇无此反应第四节醇的制备一、烯烃水化二、硼氢化-氧化反应三、由卤代烃水解四、由酯水解五、由酸还原COOHLiAlH4CH2OH六、由醛、酮制备1.醛、酮的还原(NaBH4,LiAlH4)2.醛、酮与格氏试剂反应RMgX与甲醛反应得伯醇,与其它醛反应得仲醇,与酮反应得叔醇。(二)酚第一节酚的结构及命名一、结构羟基直接与芳环相连分子中含有多种官能团时要按次序规则把羟基看作取代基来命名。二、命名羧酸>酯>酰卤>酰胺>腈>醛>酮>醇>胺官能团作为母体的优先次序为:第二节酚的物理性质第三节酚的化学性质OH苯环上更易发生亲电取代反应一、酚羟基的反应1.酸性酚羟基不易被取代酚的酸性比醇强,但比碳酸弱。取代酚的酸性酸性大小:14232.酚醚的生成一般是由酚在碱性溶液中与烃基化试剂作用生成3.酚酯的生成酚也可以生成酯,但比醇困难。4.与FeCl3的显色反应鉴别苯酚二、芳环上的亲电取代反应1.卤代反应常用溴水鉴别苯酚2.硝化反应3.磺化反应可逆反应酰基化反应4.傅瑞德-克拉夫茨反应:烷基化反应水杨醛(邻羟基苯甲醛)5.Reimer-Tiemann反应6.与甲醛缩合(了解)7.与丙酮缩合(了解)三、氧化反应(了解)酚易被氧化四、酚的制法1.异丙苯法(了解)2.碱熔法(三)醚一、醚的结构、分类和命名1.结构2.分类3.命名1)简单醚在“醚”字前面写出两个烃基的名称。2)混醚是将小基排前大基排后;芳基在前烃基在后,称为某基某基醚。3)结构复杂的醚醚键可做取代基二、醚的物理性质三、醚的化学性质醚是一类不活泼的化合物(环醚除外)1.钅羊盐的生成2.醚链的断裂酸性条件下断裂(2)不同卤化氢的反应活性大小依次为:HI>HBr>HCl(3)混合醚反应时,碳氧键断裂的方式:ROR\'当R为甲基或伯烷基时,反应通常以SN2的方式进行当R为叔烷基时,反应通常以SN1的方式进行当R为仲烷基时,反应方式进行根据情况而定芳香混醚断键时总是断裂烷氧键,生成酚和碘代烷不对称醚醚键的开裂取向:3o>甲基>1o>2o3.Claisen重排苯基烯丙基醚及其类似物在加热的条件下,发生分子内重排生成邻烯丙基苯酚(或对位取代苯酚)的反应,称为Claisen重排。4.过氧化物的生成(了解)醚的过氧化物不稳定,加热时易分解而发生爆炸四、醚的制备1.醇脱水此法只适用于制简单醚,且限于伯醇2.威廉姆逊合成法(A.W.Williamson)威廉姆逊合成法中只能选用伯卤代烷3.工业制法(了解)五、环醚环氧氯丙烷3–氯–1,2–环氧丙烷六、重要的醚2.环氧乙烷O环氧乙烷易开环,故化学性质活泼。(2)化学性质酸性条件下碱性条件下SN1SN2环氧乙烷的开环反应可用来制备增加两个碳原子的伯醇。不对称环氧乙烷开环酸催化碱催化3.冠醚名称:χ-冠-y能与正离子,尤其是与碱金属离子络合冠醚特点:用途:作相转移催化剂



















